จากตอนที่แล้ว (3.1) เราได้เห็นเรื่องราวของแบบจำลองอะตอมที่พัฒนาขึ้นไปเรื่อย ๆ ตามแนวคิดของนักฟิสิกส์แต่ละคน แต่ในวันนี้เราจะมาเจาะลึกเกี่ยวกับแบบจำลองอะตอมของโบร์ ซึ่งเป็นแบบจำลองที่ออกข้อสอบ A-Level บ่อยที่สุดกันครับ
และเมื่ออ่านจบเราจะมาลองทำข้อสอบ A-Level ปีล่าสุด (ปี 68) กัน รับรองว่าไม่ยากเกิน simulation ที่ “เล่นแล้วรู้เลย” ของเราแน่นอน
🧠 ทบทวนข้อเสนอของโบร์: เมื่ออิเล็กตรอนมี 'วงโคจรพิเศษเป็นชั้น ๆ'
ถ้ายังจำกันได้ โบร์ได้เสนอว่าอิเล็กตรอนไม่ตกเข้าหานิวเคลียสตรงกลางเพราะมีวงโคจรพิเศษบางชั้นเท่านั้นที่ ‘เสถียรพอ’ ที่อิเล็กตรอนจะอยู่ได้
นอกจากนี้ เรายังได้แตะถึงสมบัติที่น่าสนใจอีกอย่างนึง คืออิเล็กตรอนสามารถ ‘กระโดด’ ไปมาระหว่างชั้นได้ โดยถ้าจะกระโดดไปชั้นสูงขึ้น จะต้องรับพลังงานที่ ‘พอดี’ มาจากโฟตอนภายนอก และถ้าจะกระโดดกลับลงมา จะต้องคายพลังงานออกมาเป็นโฟตอนที่พลังงาน ‘พอดี’ กับช่วงกว้างที่กระโดดเช่นกัน ลองเล่น simulation ทบทวนกันครับ
หมายเหตุ : ตัวเลขใน simulation ด้านบนยังเป็นแค่ค่าสมมติให้เข้าใจง่าย ๆ ไม่ใช่ค่าของอะตอมจริงนะ
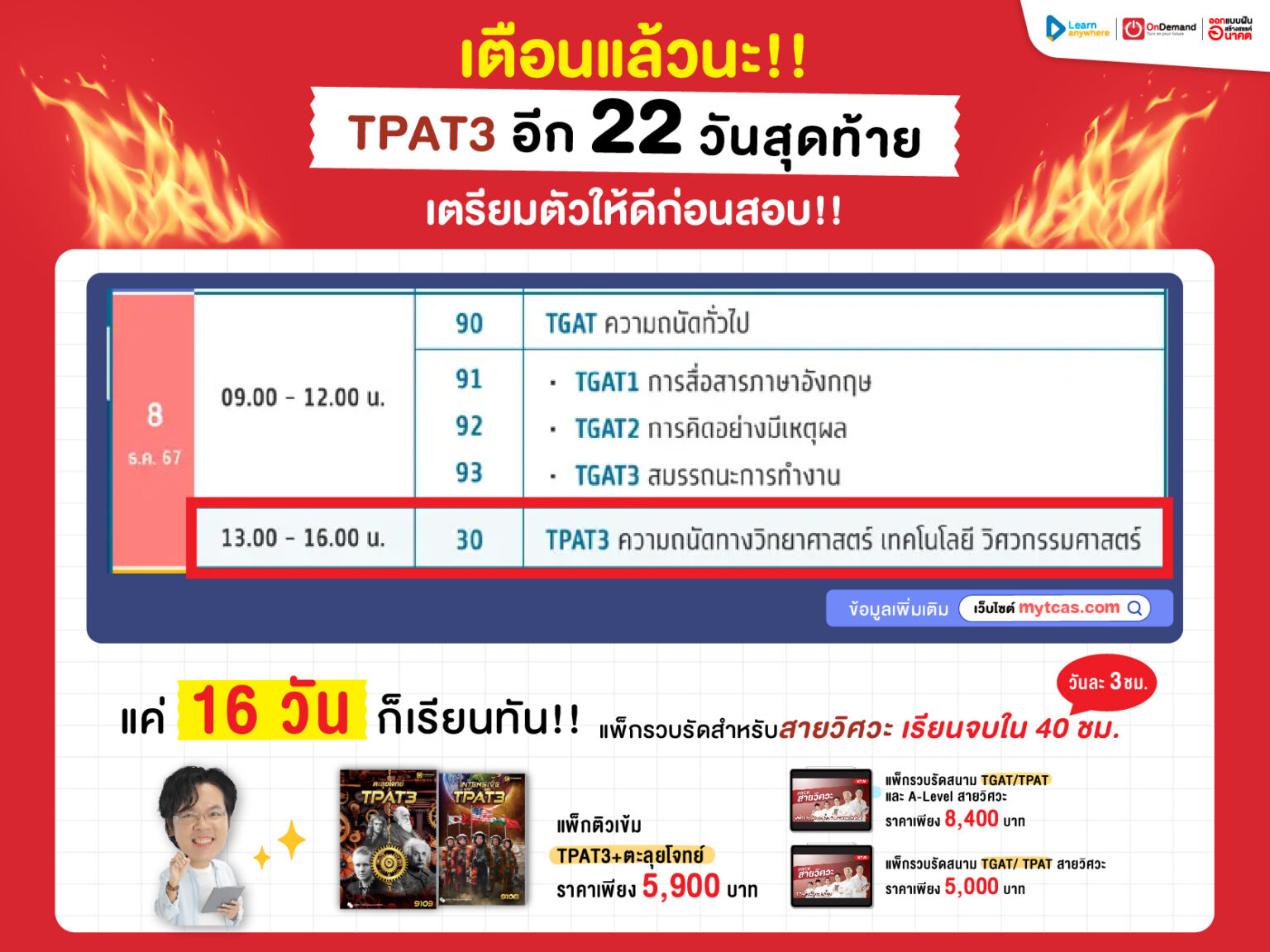
🧩 Mission Time : พิชิตโจทย์ A-Level ปี 68
มาดูโจทย์ของจริงจากข้อสอบ A-Level ปี 68 ที่เราจะมาพิชิตในวันนี้กันครับ
A-Level 68
อะตอมไฮโดรเจนเปลี่ยนระดับพลังงานจากสถานะที่ n ไปยังสถานะพื้นที่มีพลังงาน –13.6 eV โดยแผ่รังสีที่มีพลังงาน 10.2 eV ออกมา
คำถาม: n มีค่าเท่าใด
ข้อสอบนี้สั้น ๆ แต่เราลองมาวิเคราะห์กันหน่อย เพราะอาจจะมีศัพท์บางคำที่หลายคนไม่คุ้นเคย มาค่อย ๆ ดูกันนะครับ
- ข้อสอบพูดถึง ‘สถานะที่ n’ และ ‘สถานะพื้น’ : มันคืออะไร ?
- ข้อสอบบอกว่าการเปลี่ยนระดับพลังงาน (กระโดด) นี้ คายพลังงานออกมา 10.2 eV ออกมา : แล้วจะรู้ได้ยังไงว่าโดดจากไหนไปไหนจะตรงกับพลังงานเท่าไหร่ ?
ขั้นแรก : ทำความเข้าใจ 'สถานะที่ n' และ 'สถานะพื้น'
ง่าย ๆ เลยครับ ถ้าใครช่างสังเกตจะเห็นว่าใน simulation ของเรา อิเล็กตรอนมักจะเริ่มต้นอยู่ที่วงโคจรเล็กที่สุดก่อน (อยู่ใกล้นิวเคลียส) นั้นเพราะมันเป็นวงโคจรที่เสถียรที่สุด (พลังงานต่ำ) และในสถานะนี้แหละ ที่เราเรียกว่า สถานะพื้น และเราจะชอบให้เลขแทนสถานะนี้เป็นค่า n = 1
จากนั้น ระดับชั้นพลังงานสูงกว่าที่อิเล็กตรอนสามารถกระโดดขึ้นไปได้ เราก็จะเรียกไล่ลำดับขึ้นไปว่า n = 2, 3, 4, … ไปเรื่อย ๆ
ขั้นต่อไป : แล้วแต่ละชั้นมีพลังงานเท่าไหร่
ตรงนี้ต้องบอกว่าเราจำเป็นต้องยกสูตรคำนวณของน้อง ม.ปลาย มาใช้นิดนึงครับ คือสำหรับอะตอมของไฮโดรเจนจริง ๆ วงโคจรแต่ละชั้นมันจะมีค่าพลัังงานประจำตัวอยู่ ตามสมการ
$$\text{พลังงานของชั้นที่ } n = \dfrac{-13.6}{n^2} \text{ eV}$$
พอเราลองแทนค่า n = 1, 2, 3, … ดู ก็จะได้พลังงานของแต่ละชั้นตามนี้เลย
ทดลองตามโจทย์ : พลังงาน 10.2 eV จะพอดีให้โดดจากชั้นไหน ?
สุดท้าย เราลองมาให้พลังงาน 10.2 eV ตามที่โจทย์บอกกันครับ แล้วดูว่าตอนที่มันคายพลังงานนี้กลับมา มันเป็นการโดดจากชั้นไหนไปชั้นไหน
จะเห็นว่าพลังงาน 10.2 eV นี้ พอดีทำให้เกิดการกระโดดระหว่างชั้น n = 1 และ n = 2 พอดี ทั้งโดดไปและโดดกลับ
ซึ่งเหตุผลก็ง่าย ๆ แค่ว่า ค่าพลังงานของทั้งสองชั้น คือ -13.6 eV กับ -3.4 eV มันต่างกันอยู่ 10.2 eV พอดีนั้นเองครับ (ลองลบเลขดูง่าย ๆ ได้เลย)
ดังนั้น คำตอบของข้อนี้ก็คือ อิเล็กตรอนโดดจากสถานะที่ n = 2 นั้นเองครับ ✅